一、研究背景与传统治疗的局限性
狼疮肾炎的疾病负担与临床挑战
狼疮肾炎(LN)作为系统性红斑狼疮最常见的严重并发症,其本质是免疫系统异常激活导致的“敌我不分”——自身抗体与免疫复合物沉积于肾脏组织,引发慢性炎症与进行性损伤。肾脏因其高血流灌注和复杂滤过屏障结构,成为自身免疫攻击的主要靶器官,约 35%~60% 的红斑狼疮患者会发展为 LN[1]。
LN 的病理进程呈现进行性加重特征。早期以肾小球滤过膜损伤为核心,表现为尿蛋白漏出(蛋白尿)和水钠潴留(水肿);随病情迁延,肾小管间质纤维化与肾小球硬化逐步加剧,导致肾功能不可逆下降,最终约 30%~40% 的未控制病例会进展为终末期肾病(尿毒症),需依赖透析或肾移植维持生命[1]。

当前临床治疗面临严峻挑战,超半数 LN 患者对激素联合环磷酰胺等传统免疫抑制剂应答不佳,被定义为“难治性狼疮肾炎”。这类患者的疾病持续活动不仅加速肾脏纤维化进程,还显著增加感染、心血管并发症等系统性风险,成为 LN 治疗领域亟待突破的瓶颈。
临床警示:约 50% 以上的 LN 患者对传统免疫抑制治疗无应答,其肾功能恶化速度较治疗敏感者快 2.3 倍,5 年内进展为终末期肾病的风险高达 38%[1]。
难治性 LN 的高发生率与不良预后,凸显了现有治疗手段的局限性,也为靶向免疫调控的创新疗法(如 STAR-T 细胞疗法)提供了明确的临床需求与目标人群定位。
传统治疗方案的局限性与未被满足的需求
在难治性狼疮肾炎的临床治疗中,传统免疫抑制剂(如糖皮质激素、环磷酰胺等)虽为一线方案,但长期应用面临疗效瓶颈与安全性隐患,如感染风险升高、器官毒性累积及个体响应差异显著等问题,难以满足重症患者的治疗需求。近年来,以CAR-T为代表的细胞疗法为自身免疫病治疗提供了新思路,但其临床转化仍受多重限制。
传统自体抗CD19 CAR-T细胞疗法在B细胞相关自身免疫病中已显示出一定疗效,但其三大核心局限显著制约了临床应用:
传统自体CAR-T的核心局限:
① 个性化制备周期长,需患者停药1个月以采集T细胞,危重患者在此期间易出现病情恶化;
② 生产成本高昂,难以实现广泛普及;
③ CAR基因随机插入基因组可能引发插入突变等安全风险。
而异体CAR-T疗法虽可通过标准化制备缩短周期、降低成本,却常因移植物抗宿主病(GVHD)和宿主抗移植物反应(HVG)导致治疗失败,临床应用受限[1]。上述传统治疗手段在疗效持久性、安全性及可及性上的多重痛点,凸显了开发新型细胞疗法(如STAR-T)的迫切需求,以突破现有治疗范式的局限。
二、STAR-T细胞疗法的开发与技术创新
STAR-T细胞的基因编辑策略与作用机制
STAR-T细胞的基因编辑策略通过多层次精准修饰,构建了“精准编辑—低免疫原性—高效靶向”的技术体系,其核心在于通过基因编辑工具实现治疗序列的稳定整合、免疫原性降低及效应功能增强的协同优化。以CD19靶向STAR-T细胞产品YTS109为例,其基因编辑策略采用CRISPR-Cas9与AAV介导的组合技术,具体包括以下关键环节:
TRAC基因座的精准整合是实现STAR序列稳定表达的基础。T细胞受体α链恒定区(TRAC)基因座作为内源性T细胞受体(TCR)的表达位点,具有持续且稳定的转录活性。YTS109通过AAV载体将抗CD19 STAR序列定向整合至TRAC基因座,不仅可替代内源性TCR的表达,避免TCR与STAR的竞争性表达干扰,还能利用TRAC启动子的天然调控机制,确保STAR受体在T细胞表面的持续、均一表达,从而维持长期的靶向识别能力[1]。这种整合方式有效解决了传统病毒载体随机插入导致的表达不稳定或基因组毒性问题,为STAR-T细胞的“精准编辑”奠定基础。
HLA相关基因的联合敲除是降低免疫原性、规避移植物抗宿主病(GVHD)的关键策略。YTS109通过CRISPR-Cas9同时敲除HLA-A、HLA-B及CIITA基因:HLA-A和HLA-B作为主要组织相容性复合体I类(MHC-I)分子的核心亚基,其缺失可显著减少宿主T细胞对异体STAR-T细胞的识别;CIITA作为MHC-II类分子转录激活因子,其敲除可进一步抑制MHC-II类分子的表达,从而降低抗原呈递细胞对STAR-T细胞的免疫攻击[1]。这种多基因联合编辑策略显著降低了STAR-T细胞的免疫原性,为“即插即用”的异体通用型细胞产品开发提供了可能。
PD1敲除则通过解除免疫检查点抑制,增强T细胞对B细胞的清除效率。程序性死亡受体1(PD1)在活化T细胞表面高表达,其与配体PD-L1结合后可诱导T细胞耗竭。YTS109通过敲除PD1基因,阻断PD1/PD-L1通路介导的免疫抑制信号,使STAR-T细胞在肿瘤微环境或自身免疫病病理环境中维持更强的增殖活性和细胞毒性,从而高效清除CD19阳性B细胞[1]
。这一编辑策略直接提升了STAR-T细胞的“高效靶向”能力,尤其适用于难治性自身免疫疾病中持续活化的B细胞清除需求。
STAR-T细胞的基因编辑策略通过TRAC基因座精准整合(确保表达稳定性)、HLA相关基因敲除(降低免疫原性)及PD1敲除(增强效应功能)的协同作用,构建了“精准编辑—低免疫原性—高效靶向”的技术逻辑,为异体通用型细胞治疗产品的临床转化奠定了基础。
YTS109产品的制备流程与特性
YTS109作为一种新型异体CD19靶向STAR-T细胞产品,其制备流程融合了基因编辑技术与精准整合策略,旨在实现低免疫原性与“即插即用”的临床应用价值。该产品以健康供者外周血单个核细胞(PBMC)为起始原料,通过多步骤基因工程改造与体外培养工艺完成制备,具体流程如下:
制备流程
原料获取与初始处理:采用健康供者外周血单个核细胞作为基础细胞来源,确保原料的普适性与安全性,避免自体CAR-T疗法中患者自身细胞质量不佳的限制[1]。
多基因精准敲除:利用CRISPR-Cas9基因编辑技术,定向敲除TRAC(T细胞受体α链恒定区)、PD1(程序性死亡受体1)、HLA-A、HLA-B(主要组织相容性复合体I类分子)及CIITA(MHC II类反式激活因子)基因。其中,TRAC敲除可消除内源性TCR表达,避免移植物抗宿主病(GvHD)风险;PD1敲除可解除肿瘤微环境对T细胞的免疫抑制;HLA-A/B及CIITA敲除则显著降低异体T细胞的免疫原性,减少宿主抗移植物反应(HvG)[1]。
STAR序列靶向整合:通过腺相关病毒(AAV)介导,将抗CD19 STAR(Synthetic T Cell Receptor And Antigen Receptor)序列精准整合至TRAC基因座。这一设计确保CAR表达的均一性与稳定性,同时避免随机整合导致的基因毒性风险[1]。
体外扩增与纯化:经基因编辑的细胞在体外培养体系中进行扩增,通过严格的纯化工艺去除未编辑细胞及杂质,最终获得高纯度、高活性的STAR-T细胞产品[1]。
核心特性与临床价值
YTS109的核心特性体现为低免疫原性异体CAR-T产品与**“即插即用”的治疗模式**。其通过多重基因编辑策略(HLA-A/B、CIITA敲除)显著降低了异体T细胞的免疫原性,突破了传统异体CAR-T的免疫排斥瓶颈;而健康供者来源的普适性原料与标准化制备流程,使其可预先批量生产并储存,实现“即插即用”的快速临床应用[1]。
临床意义:相较于自体CAR-T疗法需2-4周的个体化制备周期,YTS109的“即插即用”特性可将治疗启动时间缩短至数小时内,为进展迅速的重症狼疮肾炎患者提供了及时干预的可能,尤其适用于造血功能受损或无法等待自体细胞制备的患者群体。
综上,YTS109通过基因编辑技术与异体来源策略的结合,在保证靶向杀伤CD19阳性细胞功能的同时,解决了传统CAR-T疗法的制备周期长、免疫原性高等关键问题,为狼疮肾炎等B细胞介导的自身免疫性疾病提供了创新治疗方案。
三、临床试验设计与方法
研究对象与入组标准
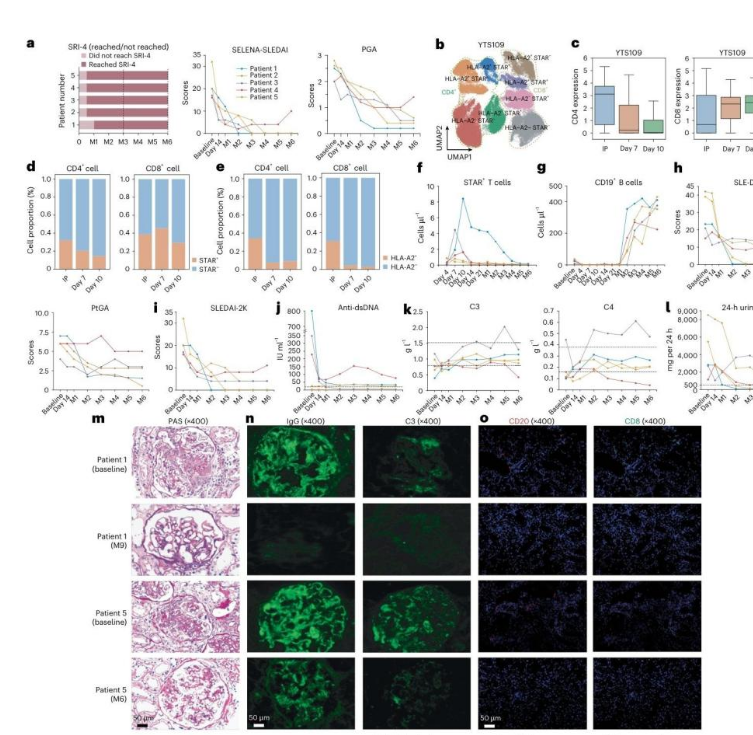
本研究作为针对自身免疫病的Ⅰ期“篮子试验”(覆盖 6 种自身免疫病)的一部分,核心纳入 5 例严重难治性系统性红斑狼疮(SLE)合并狼疮肾炎(LN)患者。入组患者的基本特征为:4 例女性、1 例男性,年龄范围 23~41 岁,SLE 病程 3~30 年,均符合 2019 年 EULAR/ACR SLE 分类标准[1]。
重症难治性临床特征:该队列患者呈现典型的“重症难治”特点,表现为长期病程(最长达 30 年)且经多线标准治疗失败,包括糖皮质激素、环磷酰胺(CTX)等免疫抑制剂规范治疗后,病情仍持续活动且未达到临床缓解标准[1]。
在肾脏病理分型方面,所有患者的 LN 均经肾活检证实为 ISN/RPS Ⅲ+V 型或Ⅳ+V 型。此类病理亚型具有明确的预后不良属性,临床研究已证实其进展至终末期肾衰竭的风险显著高于其他亚型,是狼疮肾炎治疗中的高难度人群[1]。该人群对现有治疗手段的应答率低、复发率高,其未被满足的医疗需求为 STAR-T 细胞疗法等创新治疗策略的临床价值评估提供了关键研究背景。
治疗方案与试验终点设计
在STAR-T细胞疗法治疗难治性狼疮肾炎的临床研究中,治疗方案与试验终点的科学设计是评估疗法安全性和有效性的核心框架。预处理方案的选择以清除体内淋巴细胞、为STAR-T细胞输注创造定植空间为核心目标,目前临床采用氟达拉滨(FLU)联合环磷酰胺(CTX)的经典淋巴清除方案:患者于治疗前5~3天接受FLU(25~30 mg/m²/天)联合CTX(1000 mg/m²)预处理[1]。该方案通过FLU的嘌呤类似物作用抑制淋巴细胞增殖、CTX的烷化剂效应诱导淋巴细胞凋亡,双重机制协同降低免疫抑制环境对输注T细胞的清除压力,为后续细胞植入与扩增奠定基础。
输注剂量的设定基于疗效与安全性平衡原则,采用单次静脉输注YTS109(靶向CD19的STAR-T细胞),剂量为每千克体重3×10⁶个STAR⁺ T细胞[1]。这一剂量参考了CAR-T细胞治疗血液肿瘤的临床经验,同时考虑到狼疮肾炎患者的免疫状态与器官功能储备,在保证足够抗肿瘤活性的同时降低细胞因子释放综合征(CRS)等毒性风险。
试验终点设计体现了从基础安全到临床获益的多维度评估逻辑,按重要性排序如下:
1. 主要终点聚焦治疗后3个月(M3)的安全性及SLE应答指数4(SRI-4)。SRI-4作为系统性红斑狼疮(SLE)疗效评估的权威标准,需同时满足以下条件:① 临床SLEDAI-2K评分较基线降低≥4分;② 无新的BILAG A类评分或≥2个新的BILAG B类评分;③ 医师整体评估(PGA)评分无恶化(较基线增加<0.3分),其综合性与严谨性已被多项国际多中心研究验证,可客观反映疾病活动度改善[1]。
2. 次要终点进一步扩展评估维度,包括治疗后6个月(M6)的SRI-4应答持续性、临床缓解率及生活质量综合评估。生活质量通过SF-36(健康调查简表,涵盖生理功能、情感角色等8个维度)、FACIT-F(疲劳评估量表)、PtGA(患者整体评估)及EQ-5D-5L(健康效用评分)等多量表组合实现,突破传统客观指标局限,从患者主观感受层面量化治疗获益,如躯体功能恢复、疲劳症状缓解及心理健康状态改善[1]。
3.探索性终点则针对狼疮肾炎的特异性病理生理机制,涵盖肾活检(评估肾脏组织学改变)、抗dsDNA抗体水平(反映自身免疫活性)及补体(C3/C4)水平(提示免疫复合物清除状态)等,为阐释STAR-T细胞的肾脏保护机制提供生物学证据[1]。
核心设计要点总结
预处理方案:FLU(25~30 mg/m²/天)+ CTX(1000 mg/m²),治疗前5~3天给药,实现淋巴清除。
输注剂量:3×10⁶个STAR⁺ T细胞/kg,单次静脉输注,平衡疗效与安全性。
终点分层:主要终点(M3安全性+SRI-4)→ 次要终点(M6应答+生活质量)→ 探索性终点(机制指标),构建“安全-疗效-获益-机制”完整证据链。
上述设计通过标准化预处理方案、精准剂量控制及多维度终点体系,确保了试验结果的科学性与临床转化价值,为STAR-T细胞疗法在难治性狼疮肾炎中的应用提供了严谨的评价框架。
三、临床疗效与安全性结果
主要临床应答与疾病缓解
STAR-T细胞疗法在难治性狼疮肾炎患者中展现出显著的临床应答与疾病缓解效果,其核心疗效可通过SLE应答指数4(SRI-4)、SLE活动评分及免疫指标的动态变化综合评估。
核心临床应答指标:5名接受STAR-T治疗的患者在治疗后3个月(M3)均达到SRI-4响应,并持续至第6个月(M6),实现100%的应答率及长期稳定性[1]。这一结果直接证实了STAR-T疗法对难治性狼疮肾炎的强效且持久的治疗作用。
在疾病活动度控制方面,4名患者的SLE活动评分在M6时呈现迅速且持续的降低趋势,提示病情得到有效控制;仅1例患者在M6时出现轻度难治性复发,整体表现出良好的病情稳定性[1]。从免疫机制层面分析,STAR-T疗法通过清除致病性B细胞,显著降低患者体内自身抗体水平,同时促进补体系统(如补体C3、C4)的恢复,这一免疫调节过程为临床应答提供了关键机制解释——B细胞耗竭后自身抗体生成减少,补体激活途径受抑,从而减轻肾脏炎症损伤并维持疾病缓解状态。
肾脏功能改善与组织修复证据
肾活检作为评估肾脏组织病理学变化的金标准,为 STAR-T 疗法的肾脏修复效应提供了直接且客观的证据,有效弥补了临床症状改善评估中可能存在的主观性偏差。研究结果显示,接受 STAR-T 细胞治疗后,患者肾脏组织的炎症反应显著消退,同时伴随明确的组织修复迹象
[1] 。这种病理层面的改善与临床观察到的尿蛋白水平降低、水肿消退等症状缓解形成了“病理改善—临床症状缓解”的协同证据链,进一步凸显了 STAR-T 疗法在难治性狼疮肾炎(LN)患者中独特的肾脏保护价值。
关键病理发现:STAR-T 细胞治疗后,肾活检结果明确证实患者肾脏炎症消退和组织修复,为疗法的肾脏靶向修复作用提供了权威组织学依据[1]。
通过将肾活检的客观病理结果与临床症状改善相结合,不仅验证了 STAR-T 疗法在控制肾脏局部炎症方面的有效性,更揭示了其促进肾脏组织结构修复的潜在机制,为 LN 患者的肾脏功能保护和长期预后改善提供了新的治疗思路。
安全性与耐受性评估
在细胞免疫治疗领域,移植物抗宿主病(GVHD) 与细胞因子释放综合征(CRS) 是制约异体CAR-T等疗法临床转化的关键安全性挑战。其中,GVHD作为异体免疫细胞攻击宿主组织的严重并发症,其高发生率和致死风险显著限制了异体疗法的适用范围。相比之下,STAR-T细胞通过精准基因编辑技术实现了低免疫原性改造,在临床研究中展现出显著的安全性优势:所有接受治疗的患者均未出现GVHD相关临床表现,从根本上规避了这一异体治疗的核心风险[1]。
关于CRS这一常见免疫治疗相关不良反应,STAR-T疗法同样表现出良好的可控性。临床数据显示,仅有少数患者出现轻度CRS(1-2级),主要临床表现为低热(体温<38.5℃)和短暂乏力,未观察到3级及以上严重CRS病例。所有CRS事件均通过常规对症处理(如非甾体抗炎药退热、短期糖皮质激素干预)实现快速缓解,无患者因CRS需进入重症监护或中断治疗,提示STAR-T的CRS反应具有自限性和可管理性[1]。
核心安全性特征总结
无GVHD风险:基因编辑介导的低免疫原性改造彻底消除移植物抗宿主反应;
轻度可控CRS:仅少数患者出现1-2级CRS,常规处理后均顺利缓解,无严重不良事件发生。
上述安全性数据为STAR-T疗法的临床转化提供了关键支撑,其在规避GVHD风险的同时实现了CRS的有效控制,显著降低了临床应用门槛,为难治性狼疮肾炎患者提供了兼具疗效与安全性的创新治疗选择。但临床样本少,慰劳有望实验、探索联合治疗,推动自身免疫病精准治疗,帮患者改善生活。
这个帖子发布后其中信息可能随时间推移发生改变或有所发展